 |
【蘇州(中国)2017年5月8日PR Newswire=共同通信JBN】
*抗PD-1 mAbは当社の前臨床研究における持続的な抗腫瘍活動を実証
中国・蘇州のBiobay 工業園区にある中国のバイオテクノロジー企業Stainwei Biotech, Inc.(蘇州思担維生物技術有限公司、Stainwei)は3日、米特許商標局(USPTO)から、同社の新しいヒト化抗VEGFモノクローナル抗体(mAbコード名:hPV19)について特許証を受けたと発表した。この特許はStainweiが2013年に提出した国際特許条約の申請(PCT/CN2013/086542)を介して交付された。米特許を受ける以前、Stainweiはこの抗体に関する2つの特許証を2015年と2016年にChina Intellectual Property Office(中国国家知識産権局)から既に受けている。Stainweiはがん、加齢性黄斑変性症(AMD)、免疫関連疾患を標的とした新しい治療用抗体薬のイノベーションと開発に専念している。
がん患者に対するhPV19の安全性と有効性の評価を行う第I相の臨床試験は中国で実施中である。Stainweiから発表されたデータによると、hPV19には特有の抗原認識部位(エピトープ)があり、同じ抗原を標的にする市販されている他の抗体とは異なるアミノ酸配列から成っている。体外と体内試験の両方で、hPV19はアバスチンより6-8倍高い生物学的活性が認められた(アバスチンの薬剤名:Roche/Genentechの抗VEGF mAbのbevacizumab。世界で最初に、そして現在も、市場において米食品医薬品局(FDA)に承認された唯一の抗VEGF mAb薬である)。Stainweiの共同創立者であるチュンミン・ゾウ博士は「前臨床の動物実験とがん患者の初期臨床試験でhPV19は優れた安全性と耐性のプロファイルを実証した。われわれは現在実施している臨床試験で、その有効性を試すことに興奮している。同時に、われわれの患者に利益をもたらすユニークでバイオシミラーがなく、より強力な治療薬をマーケットに投入することにわくわくしている」と述べた。
Stainweiは一方で、加齢性黄斑変異症(AMD)、糖尿病性黄斑浮腫(DME)、VEGFの介在による血管過成長に関連する眼疾患の治療を目的として新しいhPV19 mAb製剤設計のためのPCT特許申請を提出した。StainweiはAMDに関する前臨床試験と研究新薬(IND)の申請を完了し、DMEについては間もなく中国FDAに提出する。
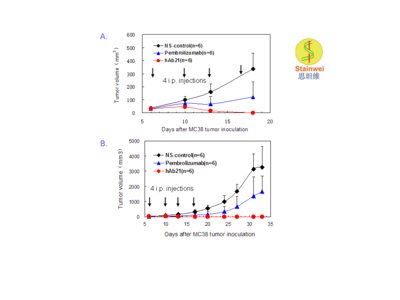
Stainweiのもう1つの有望視される製品はhAb21(ヒト化IgG4-kappa version)と名付けられた新しい抗PD-1モノクローナル抗体である。hAb21はキートルーダ(Merck)やオプジーボ(ブリストル・マイヤーズスクイブ)のそれと異なり、ヒトPD-1抗原の特有な部位(エピトープ)に結合する。hAb21はヒトPD-1遺伝子ノックイン・マウスモデルにおいて目覚ましい抗腫瘍活性を示した。
上記の数字に示したように、PD-1遺伝子ノックイン・マウスに移植されたシンジェニックMC38腫瘍はその後の再増殖もなく、hAb21を受けた6匹のマウスのグループにおいて、7-10日以内で完全に拒絶された。さらに、こうしたマウスには30日目にMC38腫瘍接種が再び実施され、追加のhAb21治療なしで10-14日以内に、またしても腫瘍は完全に拒絶された。全ての6匹のマウスは60日目も生存し、3回目のMC38接種を受けた(試験は継続中)。キートルーダ(ペムブロリズマブ)を施した同じノックイン・マウスでは、完全な腫瘍拒否が見られたのは6匹のマウスの中の1匹だけで、キートルーダ治療完了後の腫瘍再増殖に続く初期の腫瘍退縮は他の5匹にも認められたが、その全てのマウスは腫瘍進行により死亡した。
こうした有望な結果に基づき、StainweiはhAb21の特許申請を提出し、現在はIND実用化の研究を進めている。進行性固形がんへのINDの適応は中国FDAと米国FDAに、2017年下期に提出されると見られている。
▽Stainwei Biotech, Inc.について
Stainwei (www.stainwei.cn )は中国の蘇州Biobay(蘇州生物納米科技園)で2007年5月に設立された。現在、10以上のモノクローナル抗体をパイプラインに持ち、VEGF、PD-1/PD-L1、PD-1H(VISTA)、CTLA-4、SOSTといったよく知られている抗原、あるいは今回は明らかにされなかった他の潜在的な標的をターゲットにしている。Stainweiは創立以来、1億人民元以上のベンチャーキャピタル・ファンドを多くの団体から受けている。それに含まれるのはCowin Venture(蘇州)、Xiangtang Venture(蘇州)、Fortune-link(上海)、Comway Capital(安徽)である。当社の治療用抗体プログラムは中国政府、江蘇省、蘇州市、シンガポール中国蘇州工業園区(Singapore-China Suzhou Industrial Park、SIP-Suzhou)から研究許可を受けている。
▽問い合わせ先
BD@stainwei.cn または zhoujim@stainwei.cn
写真リンク:
ソース:Stainwei